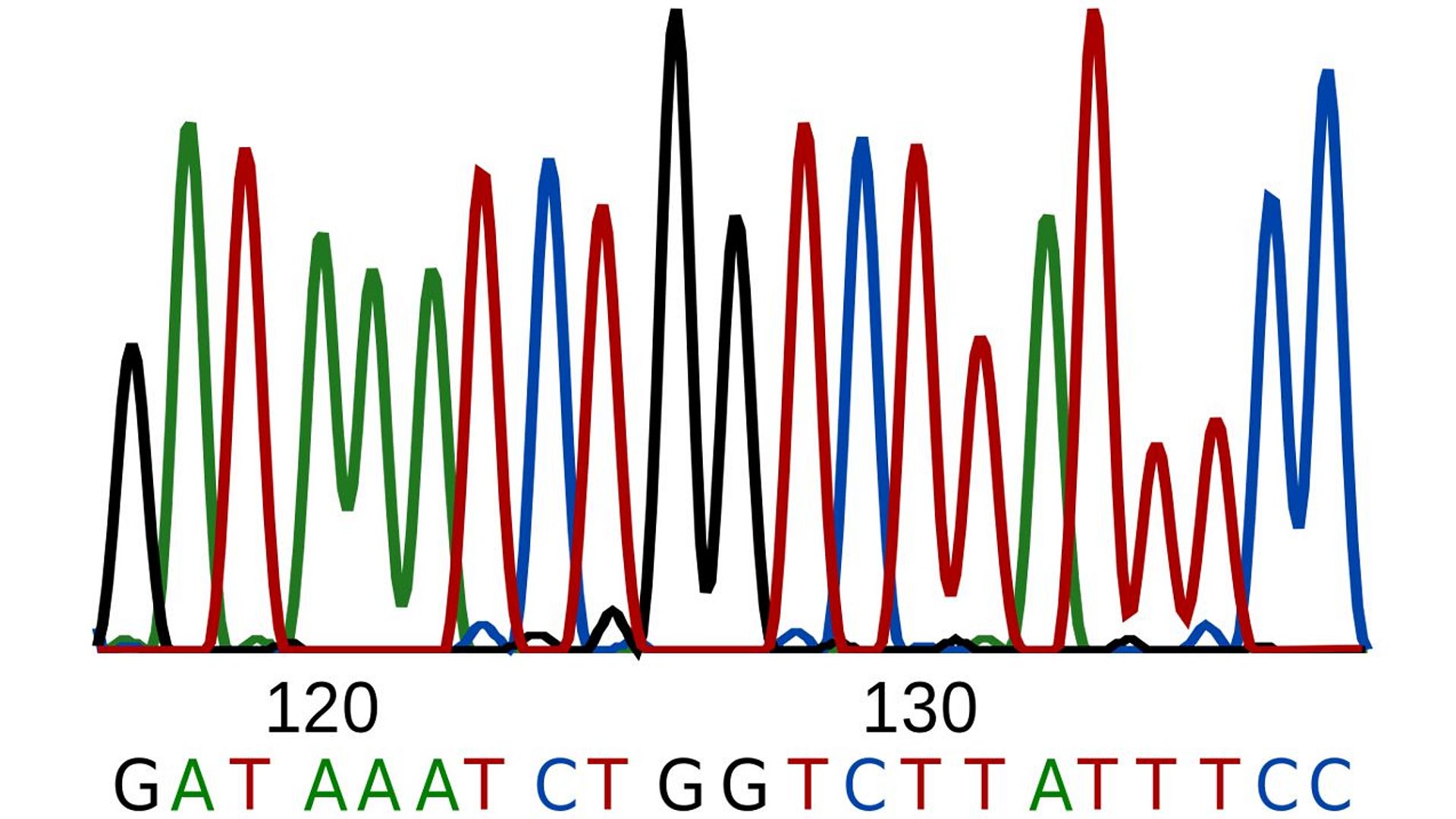
Die per PCR vervielfältigten Fragmente lassen sich nun wie gesagt auf vielfältige Weise weiterverwenden – zum Beispiel für eine Sequenzierung. Dies bedeutet man entschlüsselt ganz genau die Basenabfolge der Bausteine auf der DNA. Zunächst einmal wollten Forschende einfach nur herausfinden, wie viele Gene verschiedene Organismen haben und welche Funktionen die einzelnen Gene innehaben. Kennt man dann die normale Sequenz eines Gens, lassen sich so per Vergleich Mutationen herausfinden. Oder man vergleicht Gene um herauszufinden ob zwei Organismen miteinander verwandt sind.
Wenn von Sequenzierung die Rede ist, meint man zumeist die 1975 entwickelte und nobelpreisgekrönte Methode der Kettenabbruch-Reaktion, nach dem Entwickler Frederick Sanger auch oft „Sanger-Sequenzierung“ genannt. Bei der Sanger-Methode wird die DNA zunächst durch hohe Temperaturen wie bei der PCR in Einzelstränge denaturiert. Anschließend lagert sich, ebenfalls wie bei der PCR, ein Primer an einen Einzelstrang an und bildet den Start für den Anbau weiterer Nukleotide. Es gibt jeweils vier parallele Reaktionsansätze, da es vier verschiedene Bausteine, die Nukleotide, gibt. Jeweils ein Nukleotid pro Ansatz ist dabei so modifiziert, dass nach dessen Einbau kein weiteres Nukleotid mehr angebaut werden kann – es entsteht der „Kettenabbruch“. Im Resultat erhält man unterschiedlich lange DNA-Stücke, die durch eine Gelelektrophorese der Größe nach aufgetrennt werden. Durch radioaktive Markierung weiß man, welches Nukleotid jeweils das letzte im DNA-Stück ist und kann daraus die gesamte Sequenz der untersuchten DNA ableiten.